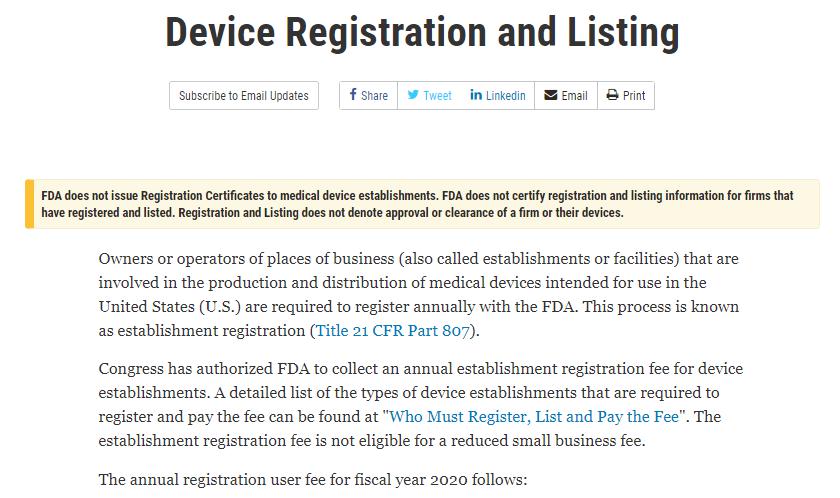
สำนักงานคณะกรรมการอาหารและยา (FDA) ได้ออกประกาศเรื่อง “การขึ้นทะเบียนและขึ้นทะเบียนอุปกรณ์ทางการแพทย์” บนเว็บไซต์อย่างเป็นทางการเมื่อวันที่ 23 มิถุนายน โดยเน้นย้ำว่า:
องค์การอาหารและยา (FDA) ไม่ได้ออกใบรับรองการขึ้นทะเบียนให้แก่สถานประกอบการผลิตอุปกรณ์ทางการแพทย์ FDA ไม่ได้ให้การรับรองการขึ้นทะเบียนและการขึ้นทะเบียนใดๆ
ข้อมูลสำหรับบริษัทที่จดทะเบียนและจดทะเบียนในตลาดหลักทรัพย์ การจดทะเบียนและจดทะเบียนในตลาดหลักทรัพย์ไม่ได้หมายความว่าบริษัทได้รับการอนุมัติหรืออนุญาตแต่อย่างใด
หรืออุปกรณ์ของพวกเขา
ประเด็นที่เราต้องให้ความสนใจในการขึ้นทะเบียนกับ FDA มีดังต่อไปนี้:
คำถามที่ 1: หน่วยงานใดเป็นผู้ออกใบรับรองจาก FDA?
A: ไม่มีใบรับรองการขึ้นทะเบียนกับ FDA หากผลิตภัณฑ์ได้รับการขึ้นทะเบียนกับ FDA แล้ว จะได้รับหมายเลขทะเบียน FDA จะส่งจดหมายตอบกลับไปยังผู้สมัคร (ลงนามโดยประธานเจ้าหน้าที่บริหารของ FDA) แต่ไม่มีใบรับรองจาก FDA
การประกาศของ FDA ในครั้งนี้ถือเป็นการเตือนที่สำคัญ! เนื่องจากสถานการณ์การระบาดของโรคในสหรัฐอเมริกาที่เกิดขึ้นเมื่อเร็วๆ นี้ ทำให้ความต้องการผลิตภัณฑ์ป้องกันโรคระบาดทางการแพทย์ที่ส่งออกไปยังสหรัฐอเมริกาเพิ่มสูงขึ้นอย่างมาก และความต้องการจดทะเบียนส่งออกก็เพิ่มขึ้นเช่นกัน
เมื่อมีบางบริษัทแอบอ้างเป็นสำนักงานคณะกรรมการอาหารและยา (FDA) เพื่อออกใบรับรองให้กับผู้ผลิต บางบริษัทจัดจำหน่ายอาจได้รับ "ใบรับรอง FDA ปลอม" เมื่อไปติดต่อขอซื้อจากผู้ผลิต
คำถามที่ 2: องค์การอาหารและยา (FDA) จำเป็นต้องมีห้องปฏิบัติการที่ได้รับการรับรองหรือไม่?
A: สำนักงานคณะกรรมการอาหารและยา (FDA) เป็นหน่วยงานบังคับใช้กฎหมาย ไม่ใช่หน่วยงานบริการสาธารณะ หากใครบอกว่าห้องปฏิบัติการของตนได้รับการรับรองจาก FDA นั่นหมายความว่าพวกเขากำลังหลอกลวงผู้บริโภคอย่างน้อยที่สุด เพราะ FDA ไม่มีบริการสาธารณะ
หน่วยงานและห้องปฏิบัติการรับรองเพศ ไม่มีสิ่งที่เรียกว่า “ห้องปฏิบัติการที่ได้รับการกำหนด” ในฐานะหน่วยงานบังคับใช้กฎหมายของรัฐบาลกลาง FDA ไม่ควรเข้าไปเกี่ยวข้องกับเรื่องต่างๆ เช่น การเป็นทั้งผู้ตัดสินและนักกีฬา FDA จะทำการทดสอบเฉพาะบริการเท่านั้น
ห้องปฏิบัติการจะมีการรับรองคุณภาพตามมาตรฐาน GMP และจะได้รับใบรับรอง แต่จะไม่ได้รับการ "แต่งตั้ง" หรือแนะนำต่อสาธารณชน
คำถามที่ 3: การขึ้นทะเบียนกับ FDA จำเป็นต้องมีตัวแทนในสหรัฐอเมริกาหรือไม่?
A: ใช่แล้ว บริษัทจะต้องแต่งตั้งพลเมืองสหรัฐฯ (บริษัท/สมาคม) เป็นตัวแทนเมื่อทำการจดทะเบียนกับ FDA ตัวแทนมีหน้าที่รับผิดชอบในกระบวนการบริการต่างๆ ในสหรัฐอเมริกา ซึ่งก็คือการเป็นสื่อกลางในการติดต่อกับ FDA และผู้สมัคร
ข้อผิดพลาดทั่วไปในการขึ้นทะเบียนกับ FDA
1. การจดทะเบียนกับ FDA แตกต่างจากการรับรอง CE รูปแบบการรับรองแตกต่างจากรูปแบบการทดสอบผลิตภัณฑ์และการรายงานผลของการรับรอง CE การจดทะเบียนกับ FDA ใช้รูปแบบการประกาศความซื่อสัตย์สุจริต กล่าวคือ คุณต้องประกาศด้วยความสุจริตใจสำหรับผลิตภัณฑ์ของคุณเอง
เพื่อให้เป็นไปตามมาตรฐานและข้อกำหนดด้านความปลอดภัยที่เกี่ยวข้อง และจดทะเบียนในเว็บไซต์ของรัฐบาลกลางสหรัฐฯ หากเกิดอุบัติเหตุกับผลิตภัณฑ์ บริษัทจะต้องรับผิดชอบตามที่กำหนด ดังนั้น ผลิตภัณฑ์ส่วนใหญ่ที่จดทะเบียนกับ FDA จึงไม่จำเป็นต้องส่งตัวอย่างไปทดสอบ
และใบรับรองผลการเรียน
2. ระยะเวลาการจดทะเบียนกับ FDA: การจดทะเบียนกับ FDA มีอายุหนึ่งปี หากเกินหนึ่งปี จะต้องยื่นขอจดทะเบียนใหม่และชำระค่าธรรมเนียมรายปีอีกครั้ง
3. บริษัทได้รับการจดทะเบียนกับ FDA และมีใบรับรองหรือไม่?
ในความเป็นจริงแล้ว ไม่มีใบรับรองสำหรับการขึ้นทะเบียนกับ FDA หากผลิตภัณฑ์ได้รับการขึ้นทะเบียนกับ FDA แล้ว จะได้รับหมายเลขทะเบียน FDA จะส่งจดหมายตอบกลับไปยังผู้สมัคร (ลงนามโดยประธานเจ้าหน้าที่บริหารของ FDA) แต่ไม่มีใบรับรองจาก FDA
ใบรับรองที่เราเห็นโดยทั่วไปนั้น ออกโดยหน่วยงานตัวกลาง (ตัวแทนจดทะเบียน) ให้แก่ผู้ผลิต เพื่อพิสูจน์ว่าได้ช่วยเหลือผู้ผลิตในการดำเนินการ "การจดทะเบียนโรงงานผลิตและการจดทะเบียนประเภทผลิตภัณฑ์" ตามที่องค์การอาหารและยา (FDA) กำหนด
(การจดทะเบียนสถานประกอบการและการขึ้นทะเบียนอุปกรณ์) เครื่องหมายที่สมบูรณ์นี้จะช่วยให้ผู้ผลิตได้รับหมายเลขทะเบียนจากองค์การอาหารและยา (FDA)
องค์การอาหารและยา (FDA) แบ่งอุปกรณ์ทางการแพทย์ออกเป็นสามประเภท (I, II, III) ตามระดับความเสี่ยง โดยประเภท III มีความเสี่ยงสูงสุด
องค์การอาหารและยา (FDA) ได้กำหนดหลักเกณฑ์การจำแนกประเภทผลิตภัณฑ์และข้อกำหนดการจัดการสำหรับอุปกรณ์ทางการแพทย์แต่ละชนิดไว้อย่างชัดเจน ปัจจุบันมีแคตตาล็อกอุปกรณ์ทางการแพทย์มากกว่า 1,700 ชนิด หากอุปกรณ์ทางการแพทย์ใดต้องการเข้าสู่ตลาดสหรัฐอเมริกา จะต้องชี้แจงหลักเกณฑ์การจำแนกประเภทและข้อกำหนดการจัดการของผลิตภัณฑ์ที่ยื่นขออนุญาตจำหน่ายก่อน
หลังจากชี้แจงข้อมูลข้างต้นแล้ว บริษัทสามารถเริ่มเตรียมเอกสารประกอบการยื่นขออนุมัติ และรายงานต่อสำนักงานคณะกรรมการอาหารและยา (อย.) ตามขั้นตอนที่กำหนดเพื่อขอรับการอนุมัติ สำหรับผลิตภัณฑ์ใดๆ บริษัทจำเป็นต้องขึ้นทะเบียนและจัดทำรายการผลิตภัณฑ์ด้วย
สำหรับผลิตภัณฑ์ประเภทที่ 1 (คิดเป็นประมาณ 47%) จะมีการควบคุมทั่วไป ผลิตภัณฑ์ส่วนใหญ่เพียงแค่ต้องจดทะเบียน ขึ้นทะเบียน และปฏิบัติตามมาตรฐาน GMP ก็สามารถเข้าสู่ตลาดสหรัฐฯ ได้ (มีเพียงไม่กี่รายการเท่านั้นที่เกี่ยวข้องกับ GMP)
ผลิตภัณฑ์ที่ได้รับการสงวนสิทธิ์จำนวนน้อยมากจำเป็นต้องยื่นคำขอ 510(k) ต่อ FDA ซึ่งได้แก่ PMN (การแจ้งเตือนก่อนวางจำหน่าย)
สำหรับผลิตภัณฑ์ประเภทที่ 2 (คิดเป็นประมาณ 46%) จะมีการควบคุมเป็นพิเศษ หลังจากขึ้นทะเบียนและขึ้นทะเบียนแล้ว บริษัทจะต้องปฏิบัติตามหลักการ GMP และยื่นคำขอ 510(k) (มีผลิตภัณฑ์เพียงไม่กี่รายการที่ได้รับการยกเว้น 510(k))
สำหรับผลิตภัณฑ์ประเภทที่ 3 (ประมาณ 7%) จะมีการบังคับใช้ใบอนุญาตก่อนวางจำหน่าย หลังจากขึ้นทะเบียนและขึ้นทะเบียนแล้ว บริษัทจะต้องปฏิบัติตามหลัก GMP และยื่นคำขอ PMA (คำขออนุมัติก่อนวางจำหน่าย) ต่อ FDA (ส่วนที่ 3)
พีเอ็มเอ็น)
สำหรับผลิตภัณฑ์ประเภทที่ 1 หลังจากที่ผู้ประกอบการส่งข้อมูลที่เกี่ยวข้องไปยัง FDA แล้ว FDA จะประกาศแจ้งเท่านั้น และจะไม่ออกใบรับรองใดๆ ให้แก่ผู้ประกอบการ สำหรับอุปกรณ์ประเภทที่ 2 และ 3 ผู้ประกอบการต้องยื่น PMN หรือ PMA และ FDA จะดำเนินการต่อ
ออกหนังสืออนุมัติการเข้าถึงตลาดอย่างเป็นทางการให้แก่บริษัทนั้น กล่าวคือ อนุญาตให้บริษัทนั้นสามารถจำหน่ายผลิตภัณฑ์ของตนในตลาดอุปกรณ์ทางการแพทย์ของสหรัฐอเมริกาโดยตรงในนามของตนเองได้
การที่สำนักงานคณะกรรมการอาหารและยา (FDA) จะส่งเรื่องขอประเมิน GMP ไปยังสถานประกอบการหรือไม่นั้น ขึ้นอยู่กับการพิจารณาของ FDA โดยคำนึงถึงระดับความเสี่ยงของผลิตภัณฑ์ ข้อกำหนดด้านการจัดการ ผลตอบรับจากตลาด และปัจจัยอื่นๆ ที่ครอบคลุม
จากข้อมูลข้างต้น เราจะเห็นได้ว่าผลิตภัณฑ์ส่วนใหญ่สามารถได้รับการรับรองจาก FDA หลังจากการลงทะเบียน การขึ้นทะเบียนผลิตภัณฑ์ และการนำ GMP มาใช้สำหรับอุปกรณ์ทางการแพทย์ หรือการยื่นคำขอ 510(k)
จะตรวจสอบได้อย่างไรว่าผลิตภัณฑ์ได้รับการขึ้นทะเบียนโดย FDA หรือจดทะเบียนตาม 510k แล้ว?
วิธีที่เชื่อถือได้ที่สุดคือ ตรวจสอบบนเว็บไซต์ขององค์การอาหารและยา (FDA)
วันที่โพสต์: 9 มกราคม 2021